SO3 + H2O → H2SO4 là phản xạ hóa thích hợp. Bài viết lách này hỗ trợ không thiếu vấn đề về phương trình chất hóa học đã và đang được thăng bằng, ĐK những hóa học nhập cuộc phản xạ, hiện tượng kỳ lạ (nếu có), ... Mời chúng ta đón xem:
Phản ứng SO3 + H2O → H2SO4
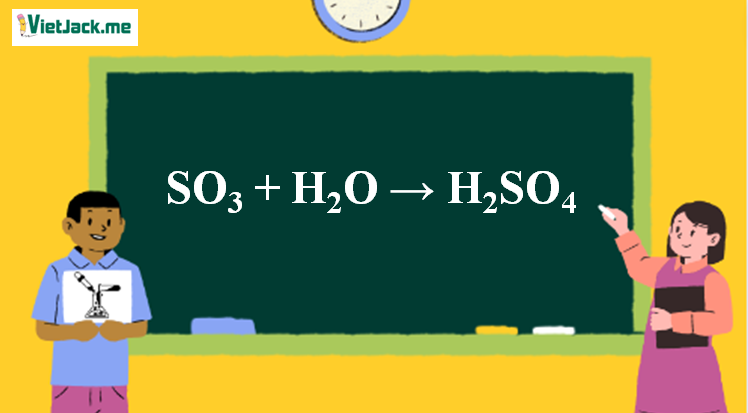
1. Phương trình SO3 đi ra H2SO4
SO3 + H2O → H2SO4
2. Điều khiếu nại phản xạ SO3 đi ra H2SO4
Nhiệt chừng thường
3. Bản hóa học của SO3 (Lưu huỳnh trioxit) vô phản ứng
SO3 sở hữu không thiếu đặc điểm của một oxit axit thuộc tính cực mạnh với nước tạo nên trở thành H2SO4.
4. Sản xuất H2SO4 vô công nghiệp
FeS2 → SO2 → SO3→ H2SO4
Phương trình hóa học
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
2SO2 + O2(k) → 2SO3(k)
SO3 + H2O → H2SO4
5. Ứng dụng của H2S04
- Trong phát hành phân bón
Axit sunfuric được sử dụng chủ yếu vô nhằm phát hành axit photphoric, một vật liệu không thể không có nhằm phát hành những loại phân photphat. Và nó cũng rất được dùng để làm phát hành Amoni sunfat.
- Trong phát hành công nghiệp:
H2SO4 được dùng rộng thoải mái vô phát hành sắt kẽm kim loại như đồng, kẽm,... và dùng để làm rửa sạch mặt phẳng thép và hỗn hợp tẩy han gỉ.
Axit sunfuric còn được dùng để làm phát hành nhôm sunfat (phèn thực hiện giấy), những loại muối hạt sunfat, sản xuất dung dịch nổ, dung dịch nhuộm, hóa học mềm, tẩy cọ sắt kẽm kim loại trước mạ, phát hành dược phẩm.
Hỗn thích hợp H2SO4 với nước được sử dụng thực hiện hóa học năng lượng điện giải trong những dạng ắc quy, axit chì,...
Mỗi năm có tầm khoảng 160 triệu tấn H2SO4 được dùng, nổ nhảy trong những ngành phát hành như phân bón 30%, hóa học tẩy cọ 14%, giấy má, sợi 8%, hóa học mềm 5%, luyện kim 2%, phẩm nhuộm 2%, ...
- Trong xử lý nước thải:
Axit sunfuric được dùng nhằm phát hành nhôm hidroxit, hóa học được sử dụng trong những xí nghiệp xử lý nước nhằm thanh lọc tạp hóa học, nâng cao vị của nước, hòa hợp chừng pH nội địa, vô hiệu hóa những Ca2+, Mg2+, sở hữu nội địa thải.
Lưu ý: Về tác sợ hãi của axit sunfuric, đấy là hóa hóa học nguy hại, hạng một làm mòn và tạo nên phỏng rộp domain authority. Vì thế Khi dùng nên chuẩn bị không thiếu những khí cụ chuyên sử dụng, mặt mày nạ chống độc cá thể, khẩu trang y tế, tủ hít khio điều chế...
6. Lưu huỳnh trioxit SO3
6.1. Tính hóa học vật lí
Điều khiếu nại thông thường, SO3 là hóa học lỏng, ko color.
Nhiệt nhiệt độ chảy: 17oC; nhiệt độ chừng sôi: 45oC.
Tan vô hạn nội địa và vô axit H2SO4.
6.2. Tính Hóa chất SO3
Là 1 oxit axit
Tác dụng với nước → hỗn hợp axit
SO3 + H2O → H2SO4
Chú ý: H2SO4 là một trong axit mạnh và sở hữu tính lão hóa mạnh.
Tác dụng với hỗn hợp bazơ (có thể tạo nên trở thành 2 loại muối hạt sunfat và hiđrosunfat)
SO3 + KOH → KHSO4
SO3 + 2KOH → K2SO4 + H2O
SO3 + NaOH → rất có thể tạo nên 2 muối: muối hạt axit hiđrosunfat (chứa ion HSO4-); muối hạt hòa hợp sunfat (chứa ion SO42-) tùy tỉ lệ thành phần.
Tác dụng với oxit bazơ → muối:
SO3 + BaO → BaSO4
6.3. Ứng dụng
Là thành phầm trung lừa lọc nhằm phát hành axit H2SO4 sở hữu vai trò số 1 vô công nghiệp.
6.4. Điều chế
Trong công nghiệp:
Phương pháp: lão hóa SO2ở nhiệt độ chừng cao.
Phương trình hóa học: 2SO2+ O2 ⇄ 2SO3 (điều kiện: 450 – 500oC; xúc tác: V2O5)
6.5. Nhận biết
Thuốc thử: hỗn hợp BaCl2
Hiện tượng: xuất hiện nay kết tủa.
Phương trình hóa học: SO3 + H2O + BaCl2 → BaSO4↓ + 2HCl
7. Tính Hóa chất của H2O
7.1. Nước thuộc tính với kim loại
Ở ĐK thông thường, nước rất có thể phản xạ với những sắt kẽm kim loại mạnh như Li, Ca, Na, K, Ba,… muốn tạo trở thành hỗn hợp Bazo và khí Hidro.
H2O + Kim loại → Bazơ + H2↑
2M + 2nH2O → 2M(OH)n + nH2↑
2Na + 2H2O → 2NaOH + H2
2K + 2H2O → 2KOH + H2
Ca + 2H2O → Ca(OH)2 + H2
Ba + 2H2O → Ba(OH)2 + H2
Đặc biệt, một số trong những sắt kẽm kim loại khoảng như Mg, Zn, Al, Fe,…phản ứng được với khá nước ở nhiệt độ chừng cao đưa đến oxit sắt kẽm kim loại và hidro. Hình như, sắt kẽm kim loại Mg tan đặc biệt chậm rãi nội địa rét.
7.2. Nước thuộc tính với oxit bazo
Nước thuộc tính với một số trong những oxit bazo như Na2O, CaO , K2O,… tạo nên trở thành hỗn hợp bazo ứng. Dung dịch bazo thực hiện mang lại quỳ tím hóa xanh xao.
H2O + Oxit bazơ → Bazơ
Na2O + H2O → 2NaOH
Li2O + H2O→ 2LiOH
K2O + H2O→ 2KOH
CaO + H2O → Ca(OH)2
7.3. Nước thuộc tính với oxit axit
Nước thuộc tính với oxit axit tạo nên trở thành axit ứng. Dung dịch axit thực hiện quỳ tím hóa đỏ chót.
H2O + Oxit axit → Axit
CO2 + H2O → H2CO3
SO2 + H2O → H2SO3
P2O5 + 3H2O → 2H3PO4
SO3 + H2O → H2SO4
N2O5 + H2O → 2HNO3
8. Bài tập luyện vận dụng
Câu 1. Cho những đánh giá sau :
(1). O3 sở hữu tính lão hóa mạnh rộng lớn O2.
(2). Ozon lão hóa được Bội nghĩa và hỗn hợp KI.
(3). SO2 thực hiện nhạt nhẽo gold color của dd nước Brom.
(4). H2SO4 quánh đặc biệt háo nước và sở hữu tính lão hóa mạnh.
(5). H2SO4 quánh hít vào SO3 đưa đến Oleum.
(6). Hiđro peoxit vừa phải sở hữu tính lão hóa, vừa phải sở hữu tính khử.
(7). Lưu huỳnh đơn hóa học vừa phải sở hữu tính lão hóa vừa phải sở hữu tính khử.
Số đánh giá đích là:
A. 4
B. 7
C. 5
D. 6
Lời giải:
Đáp án: B
Câu 2. Cho những hóa học sau: S, SO2, H2S, H2SO4, Cl2, HCl, O2, O3. Dãy bao gồm những hóa học vừa phải rất có thể nhập vai trò hóa học lão hóa, vừa phải nhập vai trò hóa học khử trong những phản xạ chất hóa học là:
A. H2S, H2SO4, Cl2, HCl
B. S, SO2, Cl2, HCl
C. S, SO2, H2S, H2SO4
D. Cl2, O2, O3
Lời giải:
Đáp án: B
Giải thích:
Dãy bao gồm những hóa học vừa phải rất có thể nhập vai trò hóa học lão hóa, vừa phải nhập vai trò hóa học khử trong những phản xạ chất hóa học là: S, SO2, Cl2, HCl.
Câu 3. Phản ứng nào là tại đây sulfur nhập vai trò là hóa học oxi hoá?
A. S + O2 SO2
B. S + 2Na Na2S
C. S + 2H2SO4 → 3SO2 + 2H2O
D. S + 6HNO3 H2SO4 + 6NO2 + 2H2O
Lời giải:
Đáp án: B
Câu 4. Nhận quyết định nào là sau đấy là đúng?
A. Kim loại sở hữu kỹ năng nhường nhịn electron chất lượng tốt rộng lớn thật nhiều đối với phi kim
B. Bán kính của nguyên vẹn tử sắt kẽm kim loại nhỏ thêm hơn đối với nửa đường kính của nguyên vẹn tử phi kim vô và một chu kì
C. Số electron phần bên ngoài nằm trong của nguyên vẹn tử phi kim tiếp tục thấp hơn số electron phần bên ngoài nằm trong của kim loại
D. Độ âm năng lượng điện của nguyên vẹn tử phi kim thông thường nhỏ thêm hơn nguyên vẹn tử kim loại
Lời giải:
Đáp án: A
Giải thích:
Vì trong một chu kì, sắt kẽm kim loại có tính âm năng lượng điện nhỏ rộng lớn phi kim => nguyên vẹn tử sắt kẽm kim loại thông thường sở hữu kỹ năng nhường nhịn electron chất lượng tốt rộng lớn thật nhiều đối với phi kim
Câu 5. Sơ trang bị pha trộn H2SO4 vô công nghiệp là:
A. FeS2 → SO2 → SO3 → H2SO4
B. S → SO2 → SO3→ H2SO4
C. FeS2→ S → SO2 → SO3→ H2SO4
D. S → H2S →SO2 → SO3 → H2SO4
Lời giải:
Đáp án: A
Giải thích:
Phương trình hóa học
4FeS2 + 11O2→ 2Fe2O3 + 8SO2
2SO2 + O2 (k) → 2SO3 (k)
SO3 + H2O → H2SO4
Câu 6. Hòa tan không còn m gam SO3 vô nước chiếm được 196 gam hỗn hợp axit sunfuric sở hữu mật độ 15%. Khối lượng m gam SO3 là
A. 20g
B. 15g
C. 25g
D. 10g
Lời giải:
Đáp án: A
Giải thích:
nH2SO4= mH2SO4/MH2SO4= (196.12,5/100)/98 = 0,25 (mol)
⇒ nSO3= nH2SO4 = 0,25 (mol)
⇒ mSO3 = 0,25.80 = đôi mươi g
Câu 7. Khi trộn lộn hỗn hợp X chứa chấp 1 mol H2SO4 vô hỗn hợp Y chứa chấp 1 mol NaOH được hỗn hợp Z. Dung dịch Z thực hiện quì tím gửi sang:
A. Màu đỏ
B. Màu xanh
C. Không màu
D. Màu tím
Lời giải:
Đáp án: A
Câu 8. Dãy những hóa học nào là tại đây tan vô nước?
A. Al2O3, CaO, P2O5, CuO, CO2
B. CuO, CaO, P2O5, CO, CO2
C. Na2O, CaO, P2O5, SO3, SO2
D. Fe2O3, BaO, SO2, SO3, SO2
Lời giải:
Đáp án: C
Câu 9. Khí sunfurơ được đưa đến kể từ cặp hóa học nào là sau đây?
A. Muối natri sunfit và axit cacbonic
B. Muối natri sunfit và hỗn hợp axit clohiđric
C. Muối natri sunfat và hỗn hợp axit clohiđric
D. Muối natri sunfat và muối hạt đồng (II) clorua
Lời giải:
Đáp án: B
Câu 10. Dãy oxit thuộc tính với hỗn hợp H2SO4 loãng là:
A. MgO, Fe2O3, SO2, CuO.
B. Fe2O3, MgO, P2O5, K2O .
C. MgO, Fe2O3, CuO, K2O.
D. MgO, Fe2O3, SO2, P2O5.
Lời giải:
Đáp án: C
Câu 11. Dãy những hóa học thuộc tính đuợc với nước đưa đến hỗn hợp bazơ là:
A. MgO, K2O, CuO, Na2O
B. CaO, Fe2O3, K2O, BaO
C. CaO, K2O, BaO, Na2O
D. Li2O, K2O, CuO, Na2O
Lời giải:
Đáp án: C
Giải thích:
C. CaO, K2O, BaO, Na2O
CaO + H2O → Ca(OH)2
K2O + H2O → 2KOH
BaO + H2O → Ba(OH)2
Na2O + H2O → 2NaOH
Câu 12. Kết luận nào là tại đây ko đúng lúc nói đến H2SO4?
A. H2SO4 loãng sở hữu không thiếu đặc điểm cộng đồng của axit
B. Khi xúc tiếp với H2SO4 quánh dễ khiến phỏng nặng
C. Khi trộn loãng axit sunfuric, chỉ được mang lại kể từ từ nước vô axit
D. H2SO4 quánh là hóa học hít nước mạnh
Lời giải:
Đáp án: C
Giải thích:
Muốn trộn loãng H2SO4 quánh, người tao xối kể từ từ axit vô nước và khuấy nhẹ nhõm vị đũa thủy tinh ma nhưng mà ko được tạo ngược lại => Phát biểu C sai
Câu 13. Nhận xét nào là tại đây ko đích về H2SO4?
A. H2SO4 tan chất lượng tốt vô nước
B. Tại ĐK thông thường H2SO4 là hóa học rắn.
C. H2SO4 sở hữu tính axit mạnh.
D. H2SO4 quánh sở hữu tính háo nước.
Lời giải:
Đáp án: B
Giải thích:
B. Tại ĐK thông thường H2SO4 là hóa học lỏng
Câu 14. Dãy hóa học thuộc tính với hỗn hợp H2SO4 loãng tạo nên trở thành hỗn hợp được màu xanh xao lam:
A. CuO, MgCO3
B. Cu, CuO
C. Cu(NO3)2, Cu
D. CuO, Cu(OH)2
Lời giải:
Đáp án: D
Giải thích:
